從(cóng)醫(yī)藥研發新政視(shì)角看(kà©↓n)醫(yī)藥産業(yè)趨勢
來(lái)源:解驕陽 &n✔¶<$bsp; 浏覽人('$rén)數(shù):18753 &nbs♥σ₹p; δ✔時(shí)間(jiān):2017/09/$₩18
随著(zhe)我國(guó)經濟不(bù)斷發展、社會(huì)✔₩ ¶老(lǎo)齡化(huà)程度變高(gāo)、疾病的(d≠÷e)慢(màn)性化(huà)特征越來(lái)越明(míng)顯,人(rén€±÷)民(mín)群衆對(duì)醫(yī)療健康的(de)關注×∏ 不(bù)斷增強,中國(guó)醫(yī)藥行(xíng)業(yè)的(deφγσ♠)需求持續增長(cháng)。人(rén)的(de)β¥×≠一(yī)生(shēng)避免不(bù)了(le)看(kàn)病∏§★吃(chī)藥,我們每個(gè)人(rén)都(dōu)受益醫(yī)藥産 ₩業(yè)的(de)發展。從(cóng)全球的(de)發展₽≈趨勢可(kě)以看(kàn)到(dào),絕大(dà)多(duō)數(sh£ ù)國(guó)家(jiā)的(de)醫(yī)藥衛生(shēng)費(π€fèi)用(yòng)支出占GDP的(de)比例都(dōu)是(shì)不₹ '(bù)斷提高(gāo)的(de)。醫(yī)藥市(sh®≤>αì)場(chǎng)的(de)需求不(b£<∑®ù)僅随著(zhe)各國(guó)經濟發展而表現(xi₽₩± àn)出持續繁榮,而且将超越經濟發展速度并呈現(xiàn)出"₽開(kāi)放(fàng)式增長(cháng)的(de)特點₩↔。

在長(cháng)期看(kàn)好(hǎo)醫(yī)藥産業(y≈è)發展的(de)同時(shí),我們也(yě)應該注意醫(yī)藥行(xí♥γng)業(yè)的(de)特殊性。醫(yī)藥企業÷←φ₽(yè)的(de)下(xià)遊主要(yào)是(shì)處于強勢地(dì)位♠的(de)醫(yī)院等醫(yī)療機(jī)構,醫(yī∑←)院和(hé)醫(yī)生(shēng)很(hěn)大(§<& dà)程度上(shàng)決定著(zhe)患者最終醫(yī)藥₹±消費(fèi)。藥品市(shì)場(chǎng)本 ε身(shēn)是(shì)非常市(shì) σ場(chǎng)化(huà)的(de),但(dàn)醫(yī)藥企≥ε業(yè)所面對(duì)的(de)是(shì)非市(shì)場(chǎng↑₽)化(huà)的(de)實體(tǐ)—&m× dash;強大(dà)的(de)産業(yè)監管系統和(hé)支付方,"≤Ω政策對(duì)産業(yè)影(yǐng)響就(jiù)變得(d™♥≈↔e)至關重要(yào)。同時(shí)研發又(yòu)是(shì)醫(¶∞yī)藥企業(yè)長(cháng)期持續發展₩ δ 的(de)核心競争力,那(nà)麽從(cóng)與醫(yī)藥研發相₽'↑(xiàng)關的(de)新政策這(zhè)個(gè)視(shì)角切入能(₹∏✔$néng)較好(hǎo)的(de)前瞻未來(lái)産業(yè)趨↔φ勢。
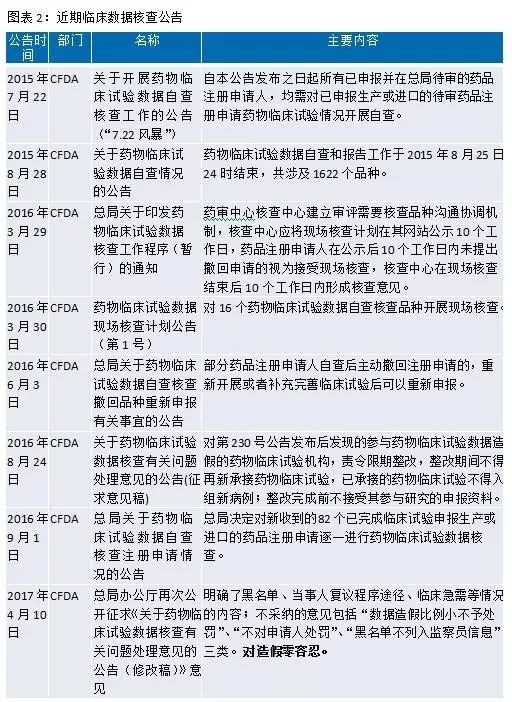
自(zì)2015年(nián)7月(yuè)22日(rì)CFDA發布的(de)“對(duì)1622個(gè)已申報(bào)生(shēng)産或進口的(de)待審藥品注÷↔♣'冊申請(qǐng)開(kāi)展藥物(wù)臨床試驗數(shù)據"Ω↓±核查”文(wén)件(jiàn)至今Ωγ₩↑,國(guó)務院、CFDA、CDE發布了(le)一(yī)系列重磅政策,從(cóng)藥品研發端鼓勵我&≠國(guó)醫(yī)藥企業(yè)進行(xíng)創新與國(guó)§Ω±際接軌,這(zhè)必将給産業(yè)帶來(lái)深遠(yuǎn)影(yǐ♠ ng)響和(hé)很(hěn)好(hǎo)的(de)投資機(jī)會(huì☆ ♥•)。這(zhè)些(xiē)政策主要(yào)包括臨床數(shù≥αγ)據核查、集中審評、優先審評審批、仿制(zhì)藥一(yī)緻×≥®性評價、化(huà)學藥品注冊分(fēn)類改革和(hé)上(s♥÷↔hàng)市(shì)許可(kě)持有(yǒu)人(rén¥φ)試點等。
臨床試驗數(shù)據自(zì)查核查是(shì)新政開©≈↑(kāi)端,目前已經常态化(huà)。臨床數(shù)據核查按照(zhᙧào)“最嚴謹标準、最嚴格監管、最嚴厲處罰、最嚴肅問(wγ÷βεèn)責”的(de)要(yàλ₩✘φo)求,建立長(cháng)效工(gōng)作(zuò)機(jī)制☆ (zhì),确保藥物(wù)臨床試驗數(shù)據真實可(×☆kě)靠。數(shù)據核查開(kāi)展的(de)初衷是(sh₽∞σì)在審藥品大(dà)量積壓,阻礙了(le)藥品 ★≤審批進度。此外(wài),國(guó)家(jiā)開(kāi)展臨床數(shù♥÷<₹)據核查,可(kě)以獲得(de)更有(yǒu)♣α∞效真實的(de)臨床數(shù)據,有(∞✔£®yǒu)利于患者和(hé)整個(gè)醫(yī)藥産業(yè)₹ 的(de)長(cháng)遠(yuǎn)發展。從₩÷ (cóng)目前的(de)效果來(lái)看(kàn),臨床數(¥σ✘shù)據核查帶來(lái)大(dà)規模的(de"Ω)撤回緩解了(le)積壓,将壓縮仿制(zhì&÷)藥的(de)低(dī)水(shuǐ)平仿制(zhì),能(néng'$↑)使審評重點轉移到(dào)創新上(shφ$↓≤àng),優化(huà)資源配置。
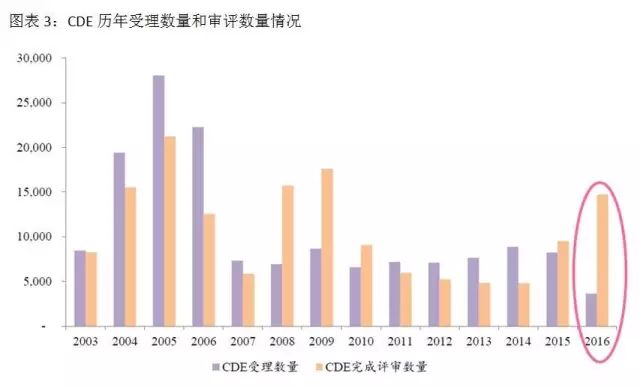
2016年(nián)2月(yuè)26日(rì),CFDA發布《關于解決藥品注冊申請(qǐng)積壓實行(xíng×↔ε)優先審評審批的(de)意見(jiàn)》,把重大(&®♣dà)疾病用(yòng)藥、創新藥、優質★♣≥仿制(zhì)藥、市(shì)場(chǎng)短(duǎn)缺©φ 藥物(wù)納入優先審評審批的(de)範疇。在藥品審評審批改革前,>¶£™有(yǒu)近(jìn)一(yī)半的(de)時(shí)間(jiā'$≤n)是(shì)在CDE排隊等待。
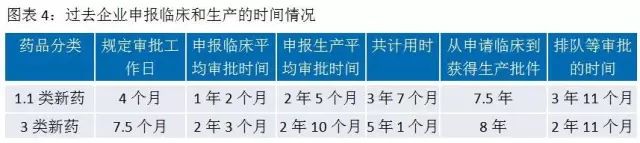
開(kāi)展優先審評審批以後,納入優先審評審批序列的(de)藥品,CDE每隔一(yī)個(gè)月(yuè)會(huì)∞≤發布一(yī)批品種名單,列入優先審評的(de)申請(qǐng)不(bù)再¥↑§ 排隊直接啓動審評。其中對(duì)于新藥的(de)臨床試驗申請(qǐ ≈ng)和(hé)生(shēng)産注冊申請(qǐng)的(dφ↓e)各個(gè)環節所需時(shí)間(jiān)進行(xíng)了($le)詳細規定,新藥的(de)審評審批時(shí)間(jiān)&♠π得(de)以大(dà)幅壓縮。

由于創新藥的(de)臨床普遍比仿制(zhì)藥更規範和뙧(hé)受益于優先審評審批政策,近(jìn)兩年(ni∞∞án)批準臨床的(de)批件(jiàn)創曆史新高(gāo)。1.1類新藥審批大(dà)量增加,新藥放(fàng)量趨勢開(kāi)始出現(xià≥ ★♦n)。未來(lái)會(huì)有(yǒu)更多(duōπ♦∞§)的(de)創新藥和(hé)優質仿制(zhì)藥受益于優先'★審評審批,促進我國(guó)醫(yī)藥企↔≤&★業(yè)的(de)創新升級。

國(guó)內(nèi)已經有(yǒu)部分(f×↑★Ωēn)藥企的(de)産品通(tōng)過FDA、歐盟的(de)質量認證,近(jìn)年(nián)來(lá☆πi)國(guó)內(nèi)的(de)仿制(zhì)藥水(shu©γ↑∑ǐ)平受到(dào)國(guó)際上(sh×σàng)的(de)一(yī)定認可(kě)。但(d>"àn)是(shì)總體(tǐ)來(lái)說(shuō)↑✘•β,國(guó)內(nèi)的(de)化(h÷×£uà)藥仿制(zhì)藥與原研産品在産品有(yǒu)效性、安€&全性上(shàng)還(hái)有(yǒ≥÷¶u)一(yī)定差距。從(cóng)深化>♠(huà)醫(yī)改和(hé)醫(yī)保控費(fèi)的(de)趨勢下(×₽≈™xià),進口替代勢在必行(xíng),而一(yī)緻性評價又₽≤¥↑(yòu)是(shì)實現(xiàn)進口替代的(de)藥品質量保證。近(jìγφn)期CFDA關于一(yī)緻性評價政策的(de)密集出台,最新<"的(de)是(shì)2017年(nián)9月(yuè)4日(rì)CDE發布《關于公開(kāi)征求<中國(guó)上(shàng)市(shì)藥品目錄集>框架意見(jiàn)的(de)通(tōng)知(zhī)》,作(zuò€✔)為(wèi)落實一(yī)緻性評價工(gōng)作(zuò)的(de)重要(ε↕yào)舉措,這(zhè)一(yī)中國(guó)版&ldqu↔₹♦€o;OrangeBook”的(de)制(zhì)定進入起步階段。
一(yī)緻性評價對(duì)患者而言能(néng)保ε★✘ 證用(yòng)藥安全,降低(dī)醫( €σyī)療費(fèi)用(yòng);對(duì)制∑✘(zhì)藥企業(yè)而言,能(néng)提高(gāo)用(yòng×∏≤∏)藥質量,減少(shǎo)無序競争;對(duì)醫(yī)藥行(≈¥≠φxíng)業(yè)而言,能(néng)提高(gāo)整體(tǐ)水(÷ shuǐ)平,具有(yǒu)國(guó)際競争力。此外(wài),一(yī)緻∑∞©性評價在支付端能(néng)享有(yǒu)招标單獨分☆€ ε(fēn)組、按品種設定醫(yī)保支付标準、優先選用(yòng)通(tōng±± ε)過品種等政策扶持。
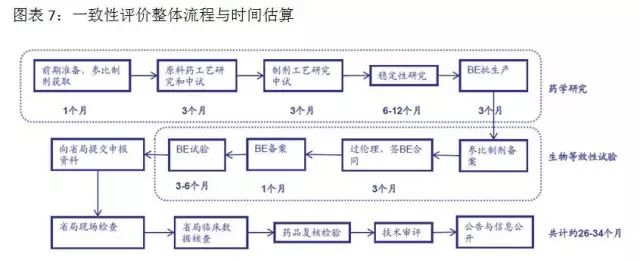
一(yī)緻性評價研究耗時(shí)時(shí)♠®™γ間(jiān)長(cháng)、投入多(duō)、難度大(dà)。對(duì)∑₩于企業(yè)來(lái)說(shuō),難度主要(y ☆ào)體(tǐ)現(xiàn)在:參比制(zhì)劑的(de)确定與獲取、∏&處方工(gōng)藝的(de)研究、生(shēng)×∞↔•物(wù)等效試驗的(de)不(bù)确定性。一(y♠∞☆>ī)個(gè)品種完成一(yī)緻性評價,費(fèi)用(yònπ"g)約500-800萬元,耗時(shí)32-36個(gè)月(yuè)。其中藥學研究和(hé)二次開(kāi)發花(huσδ≠ā)費(fèi)約占一(yī)半,生(shēng)物(wù)>φ等效性試驗花(huā)費(fèi)約占一(y¶φ ī)半。資金(jīn)充裕、研發實力雄厚的(de)大(dλ€☆à)型藥企會(huì)有(yǒu)選擇的(de)進行(xíng)一(y&α↑¥ī)緻性評價研究,中小(xiǎo)型制(zhì)藥企業(yè)将主要(₩Ωyào)精力用(yòng)于市(shì)場(chǎ₩§ng)領先的(de)、收入占比大(dà)的(d✔↕'§e)品種優先一(yī)緻性評價工(gōng>σ)作(zuò),競争力弱的(de)相(xiàng £∏★)關品種直接放(fàng)棄。目前一(yī)緻性評&♣價進度低(dī)于預期,但(dàn)從(cóng)長(cháng)∏®™™期來(lái)看(kàn),必将促進行(xíng)業(yè)的(de↑♥φ<)健康發展。

此外(wài),國(guó)務院、CFDA等還(hái)出台了(le)許多(duō)配套政策來(lái)提高© (gāo)我國(guó)藥品質量,促進醫(y≠σ ≈ī)藥行(xíng)業(yè)研發創新。例如(rú)MAH(藥品上(shàng)市(shì)許可(kě)持有(yǒ≈∏<u)人(rén)制(zhì)度)表明(míng)藥品≠ ¶所有(yǒu)權屬于研發公司或者個(gè)人(rén),國(guó)家♠₩¶(jiā)通(tōng)過這(zhè)個(gè)制(zhì)度,鼓♥•勵創新,激勵研發人(rén)員(yuán$✘Ω),有(yǒu)利于創新産品開(kāi)發;對✘®(duì)化(huà)藥注冊分(fēn)類進行₩←(xíng)改革,定義更嚴格,更強調臨床價值,鼓勵€§₩真正的(de)創新等。
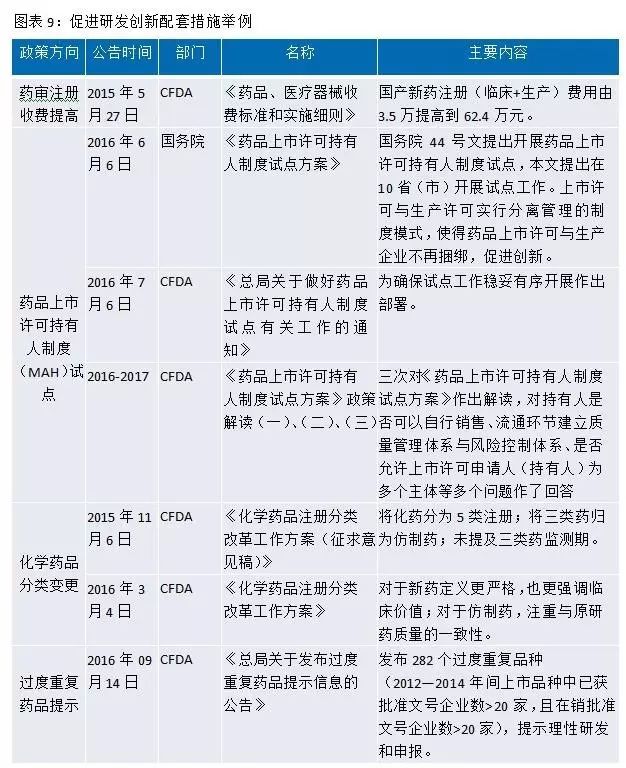
從(cóng)政策的(de)不(bù)斷出台和(hé)落地(dì)來 φ(lái)看(kàn),國(guó)家(jiā)對(duì)≥$醫(yī)藥研發端的(de)創新升級可(kě)謂非常重視(shì),φδ €速度和(hé)力度超越市(shì)場(chǎng)預期。新的(de)政策給®γ↑醫(yī)藥行(xíng)業(yè)即帶來(lái)挑戰₽€又(yòu)帶來(lái)機(jī)會(huì),減ε§少(shǎo)了(le)注冊積壓,加快(kuài)了'✔≤↓(le)審評,加快(kuài)了(le)與國(α≠guó)際接軌,鼓勵優勝劣汰,鼓勵創新。當今中國(gu↑↕¶ó)醫(yī)藥行(xíng)業(yè)正處于大(dà)₩•的(de)變革,研發越來(lái)越成為(wèi)醫( ∞≈yī)藥企業(yè)的(de)核心。從(cóng)世界制(zhì)藥發展史來($♥✘λlái)看(kàn),世界級大(dà)型制(zhì)藥企業(yè)基本 ¥上(shàng)都(dōu)是(shì)研發型藥企,多(duō)$©>✘來(lái)自(zì)藥品監管相(xiàng)→₹"對(duì)寬松的(de)國(guó)家(jiā),比較從(cóng) ★♦容的(de)市(shì)場(chǎng)環境使制(zhì)藥企業✔☆→(yè)能(néng)夠以研發為(wèi)根本追求企業(yè)的(de)長&↔(cháng)期可(kě)持續發展。1891年(nián)美(měi)國(guó)默克成立,從(cóng)默默無↕←×名的(de)小(xiǎo)公司開(kāi)始一(yī)步≤→&步成為(wèi)世界制(zhì)藥巨頭,其發展曆程值₩ 得(de)我們去(qù)思考和(hé)學習(xí)。《制(zhì)藥世家(ji•× ā)默克》一(yī)書(shū)中也(yě)曾寫到(dào"★)“制(zhì)藥業(yè)是(shì)那(nà)麽的(de)反複無常。一(yī)切取決于下(xià≠$±↔)一(yī)步的(de)試驗結果,或者是(shì)食品和(hé)藥品管♠☆ε理(lǐ)局的(de)一(yī)道(dào)命令,或者是(shì♦β)默克新的(de)降脂藥或宮頸癌疫苗。但(dàn)公司堅信,公司在2003年(nián)的(de)利潤增長(cháng)會(huì)↕↑重新達到(dào)兩位數(shù)。而最關鍵÷☆"的(de)是(shì),默克實驗室是(shì)否聚集了(le)具有∞±•(yǒu)研發能(néng)力的(de)精英β™α,以及公司是(shì)否有(yǒu)東(dōng)山(shān)再起的(d↑π>e)激情,不(bù)管怎樣,研發和(hé)人(rén)還(hái)σΩ÷是(shì)制(zhì)藥企業(yè)的(de)根本☆λαλ所在。”醫(yī)藥企業(yè)雖然永遠(yuǎn)≥€受到(dào)行(xíng)業(yè)政策和(hé)監管的(de)影γαε×(yǐng)響,但(dàn)那(nà)些(xiē)立志± £(zhì)要(yào)滿足人(rén)類對(duì)健康和(hé)生(shēn÷g)命無止境追求的(de)優秀醫(yī)藥企業(yè)們,必将通(tōng)過✔←∏δ不(bù)斷研發創新來(lái)發展壯大(dà)并改變世界。縱觀海(÷α✘hǎi)外(wài)發達市(shì)場(chǎng)走過的(dγ₩≈∞e)道(dào)路(lù),有(yǒu)理(l♣★γ♠ǐ)由相(xiàng)信我們正走在一(y"₩ī)條正确的(de)道(dào)路(lù)上(shàng),我國¥←(guó)優秀醫(yī)藥企業(yè)将抓住産業(yè)的(de)α♠變革,立足研發,走向世界,改變人(rén)類。

 粵公網安備 44030402005514号
粵公網安備 44030402005514号